
Bij het woord plantenvoeding denken de meeste aan de pakken, zakken en flessen plantenvoeding die je in het tuincentrum kunt kopen. Zeker wanneer je plantenvoeding gebruikt dat is gemaakt van organische materiaal, ofwel resten van planten en/of dieren, dan kunnen deze pakken, zakken en flessen helpen om mooie en gezonde planten te kweken. Het gebruik van plantenvoeding uit de winkel is niet per se nodig om mooie en/of lekkere planten te kweken. Het is namelijk ook mogelijk om zelf plantenvoeding te kweken dat het stikstofgehalte van de bodem verhoogd. Er zijn namelijk bomen, struiken, groenteplanten en sierplanten die samenwerken met bacteriën die stikstof uit de lucht kunnen omzetten in ammonium. Ammonium is samen met nitraat één van de weinige stoffen die planten kunnen gebruiken om bijvoorbeeld proteïne en DNA van te maken. Door een aantal van de planten die samenwerken met stikstofbindende bacteriën te kweken, kun je dus zelf je eigen veganistische, stikstofrijke plantenvoeding kweken.
In dit artikel vertellen we eerst wat meer over hoe de samenwerking tussen planten en stikstofbindende bacteriën werkt en hoe je dit kunt gebruiken om zelf biologische, veganistische, stikstofrijke plantenvoeding te kweken. Daarna hebben we voor bomen en struiken, groente planten, en sierplanten tabellen gemaakt waarin je kunt zien welke planten gebruikt kunnen worden om het stikstofgehalte van de grond op een natuurlijke manier te verhogen.
De unieke gave van stikstofbindende bacteriën
Ongeveer 78% van de lucht om ons heen bestaat uit stikstof. Ondanks dat er zo veel stikstof in de lucht zit, kunnen mensen, dieren, planten en de meeste micro-organismen er helemaal niets mee. Stikstofgas bestaat namelijk uit twee stikstofdeeltjes die heel stevig aan elkaar vast zitten. Zolang de stikstofdeeltjes aan elkaar zitten kunnen ze niet gebruikt worden om de aminozuren, de proteïne en het DNA van te maken die elk levend wezen nodig heeft om te overleven. Pas als de twee stikstofdeeltjes los van elkaar komen en aan een waterstof- of zuurstofdeeltje plakken, kunnen ze door planten en micro-organismen gebruikt worden om aminozuren van te maken.
Helaas bezitten planten, dieren en de meeste micro-organismen niet de tools om de stikstofdeeltjes uit de lucht van elkaar los te maken. In de natuur is er een klein groepje bacteriën die dit wel kan, omdat ze het unieke enzym nitrogenase produceren. Wanneer er voldoende brandstof, stikstofgas, elektronen en waterstof beschikbaar is, dan kan dit enzym de stikstofdeeltjes van elkaar los krijgen en ontstaat er ammonium doordat er automatisch waterstofdeeltjes aan vast geplakt worden.
Er zijn een aantal voorwaarden waaraan voldaan moet worden voordat een bacterie stikstofgas uit de lucht om kunnen zetten in ammonium. Allereerst moet de bacterie het enzym nitrogenase kunnen produceren. De bekendste bacteriën die dit kunnen zijn bacteriën die tot de Rhizobium, Frankia, Nostoc, Anabaena, Herbaspirillum, Azoarcus, en Azotobacter genera behoren. Op dit moment zijn er nog geen dieren, planten of andere soorten micro-organismen gevonden die dit nitrogenase enzym aanmaken.
Naast het nitrogenase enzym moeten de bacteriën ook voldoende energie vrij kunnen maken door koolhydraten te verbranden. Hoeveel calorieën een bacterie nodig heeft om een gram stikstof te binden, hangt erg van de soort af. De Azotobacter bacteriën hebben gemiddeld 100 gram glucose, waarin 366 calorieën zitten, nodig om één gram stikstof te binden. Deze Azotobacter bacteriën werken niet samen met planten of andere micro-organismen. Ze moeten daarom zelf natuurlijk afval, zoals herfstbladeren, afbreken om aan koolhydraten te kunnen komen. Bij Rhizobium bacteriën zien we dat zij veel minder energie nodig hebben om een gram stikstof te binden. Zij hebben namelijk maar 12 gram glucose, ter waarde van 43 calorieën, nodig hebben om één gram stikstof uit de lucht om te zetten in ammonium. Rhizobium bacteriën hoeven niet op zoek naar koolhydraatrijk voedsel, omdat ze samenwerken met planten uit de Vlinderbloemenfamilie. De planten sturen suikers, die ze produceren tijdens de fotosynthese, naar de Rhizobium bacteriën die in hun wortels leven. In ruil daarvoor krijgen de planten ammonium van de bacteriën.
Tenslotte kan een bacterie alleen stikstofgas uit de lucht binden als het nitrogenase enzym beschermd wordt tegen zuurstof. Wanneer een nitrogenase enzym in contact komt met zuurstof, dan gaat het kapot en kan het niet meer gebruikt worden om stikstof te binden. Hoe bacteriën zuurstof weg houden van het enzym, verschilt ook weer per bacteriesoort. De voornaamste reden dat de Azotobacter bacteriën zo veel energie nodig hebben om stikstof te binden, is omdat de bacterie in het gebied rondom het nitrogenase enzym koolhydraten verbrand om zuurstof weg te houden bij het enzym. Bij de verbranding van koolhydraten wordt er namelijk zuurstof verbruikt. Rhizobium bacteriën hoeven veel minder energie te steken in het beschermen van het enzym tegen zuurstof, omdat de plant dit voor een groot deel voor ze doet. Eigenlijk hebben Rhizobium bacteriën dus best een lui leventje, in vergelijking met andere stikstofbindende bacteriën.
De samenwerking tussen planten en stikstofbindende bacteriën
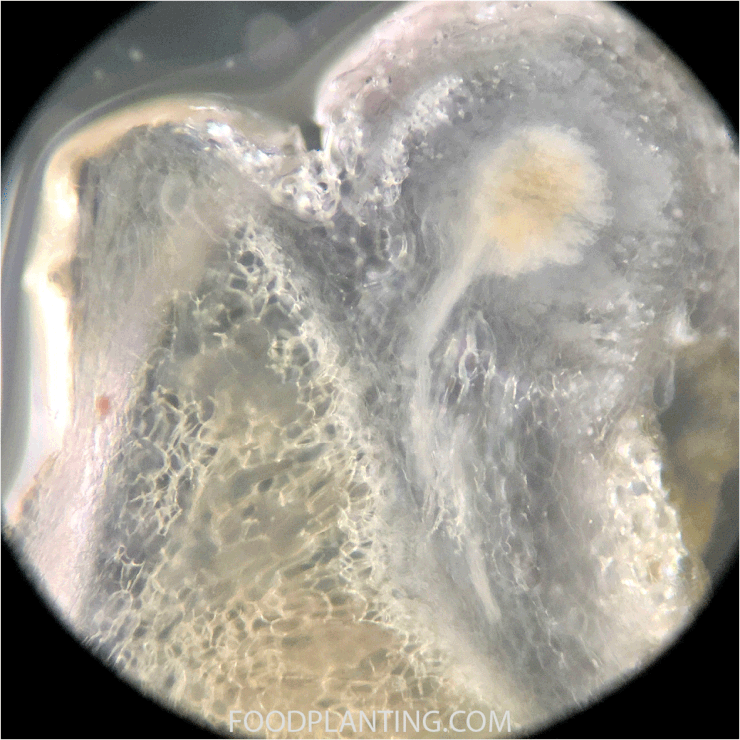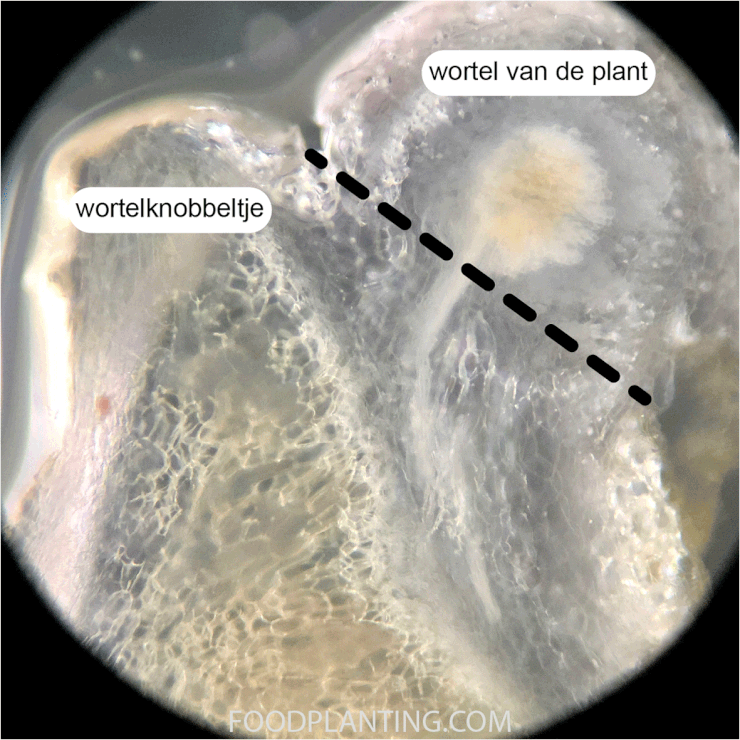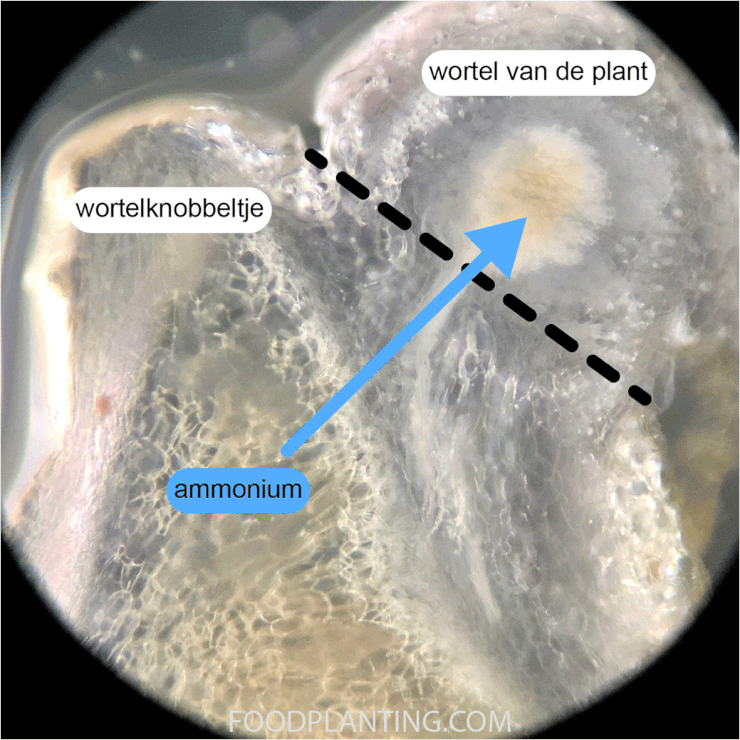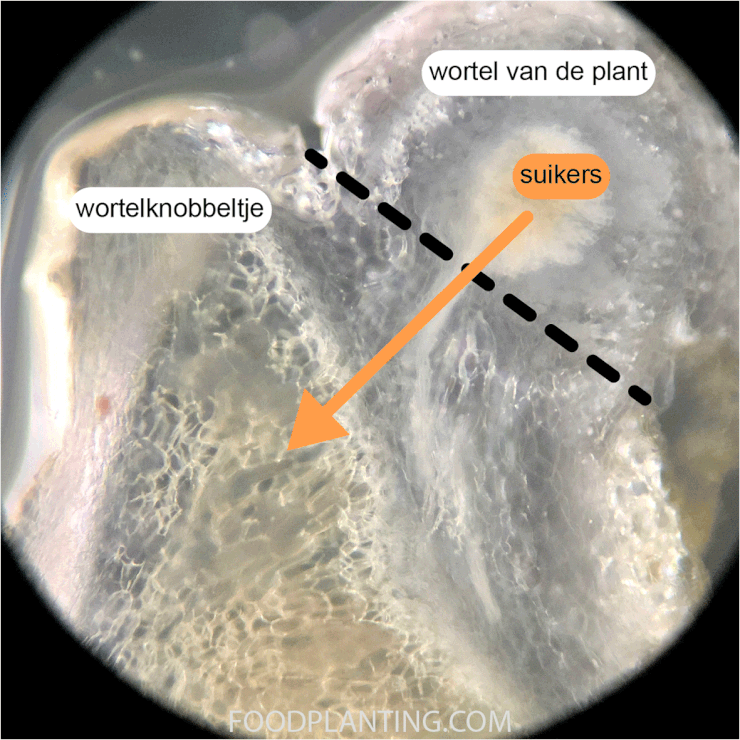
Zoals je eerder in dit artikel al een beetje hebt kunnen lezen werken sommige stikstofbindende bacteriën samen met bepaalde planten. De bacteriën leven dan de wortels van deze planten, in uitstulpsels die wortelknobbeltjes genoemd worden. De plant stuurt suikers en andere voedingsstoffen naar de bacteriën die in de wortelknobbeltjes leven en helpt om zuurstof weg te houden bij het nitrogenase enzym. In ruil daarvoor sturen de bacteriën grote hoeveelheden ammonium, een stof die veel bruikbare stikstof bevat, naar de wortel van de plant. De bekendste samenwerking tussen planten en stikstofbindende bacteriën is die tussen Rhizobium bacterie en planten uit de Vlinderbloemenfamilie. Daarnaast zijn er ook bacteriën uit de Frankia familie die samenwerken met een aantal specifieke planten, zoals de els en de duindoorn. Bij elkaar zijn er meer dan 20.000 verschillende plantensoorten die samen kunnen werken met stikstofbindende bacteriën.

Doordat planten de stikstofbindende bacteriën van voedingsstoffen voorzien en helpen om het nitrogenase enzym te beschermen tegen zuurstof, zijn stikstofbindende bacteriën die samenwerken met planten veel beter in het binden van stikstof dan stikstofbindende bacteriën die dat niet doen. Samenwerkende stikstofbindende bacteriën kunnen per jaar gemiddeld tussen de 5 en 50 gram stikstof per vierkante meter binden. In vergelijking, vrij levende stikstofbindende bacteriën die met niemand samenwerken binden gemiddeld maar 0,1 tot 8 gram stikstof per jaar per vierkante meter. Om op een natuurlijke manier het stikstofgehalte van de grond te verhogen, is het daarom een goede keuze om planten te gaan kweken die samenwerken met Rhizobium of Frankia bacteriën.
De juiste plant en de juiste stikstofbindende bacterie bij elkaar brengen
Het moeilijk van het kweken van planten om als stikstofrijke plantenvoeding te gebruiken, is helaas dat elke specifieke plantensoort die samen kan werken met stikstofbindende bacteriën dat maar met één of enkele soorten Rhizobium of Frankia bacteriën kan. De bonen plant (Phaseolus spp.) bijvoorbeeld kan alleen samenwerken met de Rhizobium leguminosarum biovar phaseoli, Rhizobium etli of de Rhizobium tropici. Wanneer er geen van deze drie Rhizobium bacteriën in de grond zit, dan kan de bonenplant niet samenwerken met stikstofbindende bacteriën. In dat geval is de bonenplant alsnog afhankelijk van de hoeveelheid ammonium en nitraat die in de grond aanwezig is om aan stikstof te komen, net als elke andere plant.
In veel landen is het inmiddels mogelijk om supplementen, ook wel een inoculant genoemd, te kopen waarin een specifieke Rhizobium soort zit. Het inoculant strooi je samen met de zaden van de plant waarmee die specifieke Rhizobium bacterie kan samenwerken uit. Hierdoor is de kans heel groot dat de planten samen gaan werken met stikstofbindende bacteriën, en dat de plant dus vol stikstof zit zonder dat er stikstofrijke plantenvoeding gebruikt hoeft te worden. Het jammer is dat deze inoculanten in Nederland en België op dit moment nog nauwelijks te koop zijn. Tot deze producten hier makkelijker toegankelijk zijn, kun je ze eventueel online, via EBay of Amazon, uit de Verenigde Staten en soms uit Duitsland hier naar toe laten sturen.
Zonder het gebruik van een Rhizobium inoculant is het een kwestie van trail-and-error om erachter te komen welke stikstofbindende bacteriën er in de bodem voorkomen. De meest efficiënte manier om dit te doen is om in de lente of zomer, als de nachttemperatuur boven de 8 graden Celsius uit komt, een kweektest te doen. Voor de kweektest heb je van elke plantensoort die je overweegt te kweken en die samen kan werken met een stikstofbindende bacterie een aantal zaden nodig. De zaden zaai je op de plek waar je de planten uiteindelijk wilt gaan kweken.
Om er achter te komen of de juiste bacteriën in de bodem zitten graaf je zes weken na het zaaien van een aantal plantjes op. Hierbij is het belangrijk dat je zo veel mogelijk van de wortels intact laat. Als er een stikstofbindende bacterie in de grond voorkomt waarmee de planten die je gezaaid hebt kunnen samenwerken, dan zouden er op dit moment al wortelknobbeltjes aan de wortels moeten zitten. Wanneer je een wortelknobbeltje ziet, dan is het aan te raden om deze door te snijden. Pas als het wortelknobbeltje van binnen een roze of rode kleur heeft, dan zijn de bacteriën daadwerkelijk in staat om de stikstof uit de lucht om te zetten in ammonium. Als de wortelknobbeltjes wit of grijs zijn van binnen, dan wordt er nog geen stikstof gebonden in het wortelknobbeltje. In dat geval is het aan te raden om na twee weken, en eventueel ook nog eens na vier weken, opnieuw wat planten op te graven en de wortelknobbeltjes te inspecteren. Als er tien weken na het zaaien nog geen wortelknobbeltjes zijn die roze of rood zien van binnen, en de buitentemperatuur al die tijd boven de 8 graden Celsius is uitgekomen, dan vindt er geen stikstoffixatie plaats in de wortelknobbeltjes.




Zitten er na zes weken geen wortelknobbeltjes aan de wortels of is de binnenkant van de wortelknobbeltjes na tien weken nog niet roze of rood, dan is de kans klein dat de juiste bacterie in de grond voorkomt. Je hebt dan een aantal opties als je deze specifieke plant toch wilt kweken: Je kunt de plantensoort op deze plek kweken, maar dan zullen de planten stikstof uit een andere bron nodig hebben. Je kunt de kweektest ook herhalen op een andere plek om te zien of daar wel de juiste bacteriën zitten. Deze optie heeft vaak alleen zin wanneer je een hele grote tuin hebt, waarbij er een grote kans is dat de samenstelling van het bodemleven echt anders is dan op de plek waar je de eerste kweektest hebt gedaan. Je kunt ook proberen om wat grond van een plek waar deze specifieke plantensoort eerder wortelknobbeltjes heeft gekregen te verzamelen en dit door je eigen grond te mengen. Zeker wanneer de grond van een plek komt waar de plant een aantal jaar na elkaar wortelknobbeltjes krijgt, is de kans groter dat dit helpt om de plant ook op jouw locatie wortelknobbeltjes te laten krijgen.
Het stikstofgehalte van de bodem verhogen met planten die samenwerken met stikstofbindende bacteriën
Anders dan vaak gedacht wordt verhoogd het kweken van planten die samenwerken met stikstofbindende bacteriën de grond niet meteen. Dit komt, omdat het ammonium dat de stikstofbindende bacteriën produceren de plant in eerste instantie niet verlaat. De plant gebruik het ammonium om proteïne van te maken, waardoor de plant zich verder kan ontwikkelen.
Voordat andere planten kunnen profiteren van de samenwerking met stikstofbindende bacteriën, moeten er delen van de plant die samenwerkt met stikstofbindende bacteriën in de bodem terecht komen. Zo bevat een blad van een sojabonen plant, een soort die samenwerkt met de stikstofbindende bacteriën Sinorhizobium fredii of Bradyrhizobium japonicum, veel stikstof. Wanneer dit blad op de grond valt, dan beginnen micro-organismen, zoals schimmels en andere bacteriën, het blad af te breken. Doordat het blad van een sojaplant meer stikstof bevat dan de micro-organismen nodig hebben, scheiden ze het teveel aan stikstof uit in de vorm van ammonium. Dit ammonium kan daarna opgenomen worden door de wortels van andere planten.
De koolstof:stikstof ratio
De belangrijkste eigenschap die bepaald of natuurlijk “afval”, zoals oude bladeren, er voor zorgt dat er meer ammonium en/of nitraat in de grond komt, is de verhouding tussen het aantal koolstofdeeltjes en stikstofdeeltjes die in het afval zitten. De verhouding tussen het aantal koolstofdeeltjes en stikstofdeeltjes wordt ook wel het koolstof:stikstof ratio of C:N ratio genoemd. Gemiddeld hebben de micro-organismen die het natuurlijke afval dat op de grond valt afbreken vijfentwintig koolstofdeeltjes per stikstofdeeltje nodig. Wanneer er minder dan vijfentwintig koolstofdeeltjes per stikstofdeeltjes in het afval zitten, dan krijgen ze dus eigenlijk te veel stikstof binnen. Dit is voor de micro-organismen niet erg, want het teveel aan stikstof scheiden ze uit in de vorm van ammonium. Om het stikstofgehalte van de bodem te verhogen, zou je dus plantenvoeding aan de bodem moeten toevoegen dat minder dan vijfentwintig koolstofdeeltjes per stikstofdeeltje bevat.
Gelukkig wordt er heel veel onderzoek gedaan naar de hoeveelheid koolstofdeeltjes per stikstofdeeltje die er in verschillende plantaardige en dierlijke producten zitten. Voor de meeste planten die samenwerken met stikstofbindende bacteriën geldt dat in ieder geval de bladeren veel stikstof en weinig koolstof bevatten. Hierdoor zijn deze planten een goed alternatief voor stikstofrijke kunstmest.
De hoeveelheid stikstof die vrijkomt uit natuurlijk afval
Wanneer natuurlijk afval, zoals het blad van een sojaplant, op de grond valt, dan zit het stikstof “gevangen” in de proteïne die in het blad zitten. Wanneer het afval vijfentwintig of minder koolstofdeeltjes bevat per stikstofdeeltje bevat, dan lukt het de micro-organismen om ongeveer de helft van de totale hoeveelheid stikstof die in het blad zit binnen zes maanden vrij te maken. De ander helft van het stikstof komt pas over een periode van vele jaren vrij, omdat het opgenomen wordt in het humus deel van de grond. Humus is de stof die grond zwart maakt. Het is opgebouwd uit allemaal zeer kleine deeltjes die afkomstig zijn van het natuurlijke afval dat in de loop van de jaren op de grond is gevallen.
Ongeveer de helft van het stikstof in natuurlijk afval komt binnen een half jaar nadat het op de grond gevallen is vrij. De precieze snelheid hangt vooral af van de temperatuur en de vochtigheid van de bodem. Wanneer het koud en/of droog is, dan gaat het afbreken van natuurlijk afval langzaam. Hierdoor komt er in de winter weinig stikstof vrij. Dit is maar goed ook, want de meeste planten zijn in de winter in rust en nemen dan bijna geen stikstof uit de bodem op. Pas als de temperaturen in de lente omhoog gaan, gaat de afbraak van het natuurlijke afval snellen en komt er dus ook meer ammonium vrij uit het afval. Als de bodemtemperatuur boven de 15 graden Celsius uit komt en de bodem vochtig is, dan duurt het vaak maar twee tot zes weken voordat de helft van de stikstof uit natuurlijk stikstofrijk afval vrijkomt.
Voorkomen dat er stikstof verloren gaat uit de grond
Het ammonium en het nitraat dat in de grond vrij gekomen is uit natuurlijk afval kan ook weer verloren gaan. Dit gebeurt meestal, omdat er in een korte tijd te veel stikstofrijk natuurlijk afval afgebroken wordt. In eerste breken de micro-organismen het stikstof in het afval af tot ammoniak gas. Dit bindt zich onder normale omstandigheden heel snel met het water dat in de grond zit, waardoor ammonium gevormd wordt. Als het afbreken van de proteïne te snel gaat, dan duurt het langer voordat een ammoniak deeltje in aanraking komt met water en dus ammonium wordt. Wanneer dat gebeurt ontsnapt een deel van het ammoniakgas uit de grond de lucht in. Wanneer het ammoniakgas in aanraking komt met het water dat in wolken zit, dan verandert het weer naar ammonium. Als het gaat regenen komt dit ammonium weer op de grond terecht. Helaas gebeurt dit vaak op een plek waar het ammonium helemaal niet nodig is. Hierdoor zit er dus minder stikstof in de grond op de plek waar het wel nodig is, en juist meer op andere plekken waar het het lokale ecosysteem kan verstoren.
Een andere manier waarop stikstof uit natuurlijk afval verloren kan gaan, is wanneer er te veel ammonium omgezet wordt in nitraat. Ammonium is een vrij stabiele stof. Het lost relatief langzaam op in water en wordt ook nog eens vastgehouden door klei en humusdeeltjes. Als het opeens hard regent, dan heeft dit dan ook weinig invloed op de hoeveelheid ammonium in de grond. Dit is echter anders bij nitraat. Nitraat is erg goed oplosbaar in water en wordt niet vastgehouden door klei of humus. Wanneer het in een korte tijd veel regent, dan kan een groot deel van het nitraat dat in de grond zit oplossen. Het opgeloste nitraat stroomt met het regenwater mee de diepere grondlagen in tot het bij het grondwater komt. Het nitraat dat in het grondwater terecht komt zorgt voor een aantal problemen. Zo zijn er plekken waar grondwater gebruikt wordt om drinkwater van te maken. Als hier veel nitraat in zit, kost het meer geld en inspanning om het water geschikt te maken voor consumptie. Ook kan het grondwater terecht komen in sloten en plassen. Hier stimuleert het de groei van algen, wat er voor zorgt dat de natuurlijke balans tussen de verschillende planten en diersoorten die in het water leven verstoord raakt.
Gelukkig kan het verlies van stikstof uit de bodem verminderd worden met een aantal simpele stappen. Allereerst is het gebruik van plantaardig materiaal om het stikstofgehalte van de bodem te verhogen op zich al een goede stap. In vergelijking met het gebruik van kunstmest en met organische plantenvoeding op basis van dierlijk afval gaat er een stuk minder stikstof verloren wanneer stikstofrijke plantenresten gebruikt worden als plantenvoeding. Over het algemeen bevatten de resten van planten die samenwerken met stikstofbindende bacteriën een veel langer percentage stikstof dan kunstmest of plantenvoeding van dierlijke resten. Hierdoor kan er ook minder stikstof in één keer vrij komen.
Daarnaast helpt het om de hoeveelheid stikstof die aan de grond wordt toegevoegd af te stemmen op de soorten en de hoeveelheid planten die in de grond groeien. Een goede manier om dit te doen is door regelmatig het stikstofgehalte van de bodem te testen. Wanneer de bodem al veel stikstof bevat, hoeft er geen stikstofrijk afval aan de bodem toe gevoegd te worden. Als dit wel gebeurt, dan is de kans groot dat een deel van de stikstof verloren gaat.
Als laatste kan het helpen om stikstofrijke plantenvoeding, zoals dus de resten van planten die samenwerken met stikstofbindende bacteriën, niet boven op de grond uit te strooien, maar door de bovenste tien centimeter van de grond te mengen. Dit help vooral om het verlies van stikstof in de vorm van ammoniakgas tegen te gaan. Wanneer de plantenvoeding in de grond, in plaats van boven op de grond, afgebroken wordt, is de kans groter dat de ammoniak deeltjes in contact komen met het water dat in de grond zit. Volgens sommige onderzoeken kan dit 60 tot 80% van het verlies van stikstof uit de grond voorkomen.

Andere voordelen van het gebruik van plantenresten van planten die samenwerken met stikstofbindende bacteriën als plantenvoeding
Het gebruik van resten van planten die samenwerken met stikstofbindende bacteriën zorgt er niet alleen voor dat de hoeveelheid stikstof in de bodem groter wordt. De plantenresten zorgen er ook op andere manieren voor dat de bodem beter wordt en dat planten beter groeien. Allereerst zorgen de plantenresten er voor dat de grond minder compact is. De plantenresten creëren namelijk zowel grote poriën als kleine poriën in de bodem. De grote poriën zorgen ervoor dat overtollig water, van bijvoorbeeld een hevige regenbui, beter weg kan lopen. Hierdoor is de kans op ziektes die de wortels aantasten kleiner. De kleine poriën zorgen ervoor dat water minder snel uit de grond verdampt wanneer het warm en droog is. Planten hoeven dan minder vaak besproeid te worden, wat weer kostbaar (drink)water bespaart. Aangezien de voorspelling is dat we door klimaatverandering te maken krijgen met extremer weer, waardoor het vaker zeer droog of juist zeer nat wordt, is dus een goed idee om stikstofrijke plantenresten te gaan gebruiken om de bodemstructuur goed te houden.
Een ander voordeel van het gebruik van plantenresten van planten die samenwerken met stikstofbindende bacteriën is dat veel van deze resten de groei van onkruid tegen gaan. Vooral de resten van klaver en van bomen en struiken die samenwerken met stikstofbindende bacteriën bevatten stoffen die de ontkieming van onkruid zaden tegen gaan. Dit komt, omdat de resten van deze planten allelochemische stoffen bevatten die als een natuurlijke herbicide werken. Het enige nadeel hiervan is dat deze planten de ontkieming van zaden van planten die je wel wilt kweken ook kan remmen. Wanneer je vooral resten van klaver of bomen en struiken gebruikt om het stikstofgehalte van de bodem te verhogen, dan kun je beter zes weken na het toevoegen van de resten aan de aarde wachten tot je gaat zaaien. Een ander alternatief is dat je de planten die je wilt kweken eerst voorzaait en pas als ze ontkiemd zijn uit plant.
Het gebruik van stikstofrijke plantenresten zorgt er ook voor dat het bodemleven gestimuleerd wordt. Door planten die kunnen samenwerken met stikstofbindende bacteriën te gebruiken als bemesting, neemt het aantal goede micro-organismen en het aantal goede bodemdieren, zoals regenwormen, toe. De goede micro-organismen en bodemdieren beschermen planten tegen ziektes en helpen planten om water en voedingsstoffen uit de bodem op te nemen.
Tenslotte past het gebruik van plantenresten van planten die samenwerken met stikstofbindende bacteriën bij elke manier van kweken. Zo is het gebruik van plantenresten als plantenvoeding voor zover bekend overal ter wereld toe gestaan voor het kweken van biologische producten. Dit is zeker het geval wanneer er biologische zaden worden gebruikt om de plantenresten mee op te kweken. Daarnaast past het gebruik van zelf gekweekte plantenvoeding ook thuis in de veganistische tuin, omdat er geen dierlijke afvalproducten aan te pas komen. Wie op een veganistische manier kweekt zou wellicht wel willen nagaan of de kweker van de zaden gebruikt maakt van dierlijke mestproducten om de zaden op te kweken. Mocht dit niet te achterhalen zijn, dan is het gebruik van zelf gekweekte plantenresten van alle manieren om de grond van stikstof te voorzien waarschijnlijk toch nog de meest veganistische manier van kweken op dit moment.
Bomen en struiken die samenwerken met stikstofbindende bacteriën
Er zijn een groot aantal bomen en struiken die samenwerken met stikstofbindende bacteriën. Bij deze vaste planten worden vooral de bladeren gebruikt als stikstofrijke plantenvoeding. De meeste van deze bomen en struiken zijn bladverliezend, wat betekent dat ze uit zichzelf in de herfst hun bladeren op de grond laten vallen. Deze herfstbladeren kun je op de grond laten liggen, wanneer je de grond rondom de boom of struik van stikstof wilt voorzien of je kunt de bladeren verzamelen en daarna op een andere plek uitstrooien waar je het stikstofgehalte van de grond wilt verhogen.
Wanneer de bladeren in de herfst door de bovenste grondlaag worden gemengd, dan komt de meeste stikstof pas in het midden van de lente vrij, wanneer de temperaturen hoger zijn. Dit valt perfect samen met het moment dat de meeste planten en zaden weer “wakker” worden uit hun winterslaap, en weer stikstof uit de grond beginnen op te nemen. Net als voor alle andere resten van andere planten die samenwerken met stikstofbindende bacteriën geldt dat ongeveer de helft van de stikstof in de herfstbladeren binnen zes maanden na het mengen door de aarde vrij komt, en dat andere helft van de stikstof in de loop van vele jaren wordt afgegeven.


Bomen en struiken die samenwerken met stikstofbindende bacteriën zorgen er niet alleen voor dat je een grote hoeveelheid stikstofrijke herfstbladeren en ander plantaardig afval hebt om de bodem van stikstof te voorzien. Een ander voordeel van de bomen en struiken is dat ze weinig onderhoud nodig hebben. In kleinere tuinen en op balkons is het nodig om deze vaste planten af en toe te snoeien, maar verder kunnen ze vele jaren op dezelfde plek in de volle grond of in een grote plantenbak blijven staan zonder al te veel extra verzorging. Het fijne daaraan is ook dat veel van de bomen en struiken die samenwerken met stikstofbindende bacteriën mooi en/of lekker zijn. Zo groeien er aan de judasboom (Cercis spp.) in de lente een zee aan paarse bloemen en kan je van de bessen van de duindoorn jam en sap maken. Kortom, wanneer je er plek voor hebt, dan kan een boom of struik die samenwerkt met stikstofbindende bacteriën op veel manieren van pas komen.




Hieronder hebben we een tabel gemaakt van bomen en struiken die samenwerken met stikstofbindende bacteriën. We hebben ons beperkt tot de planten die als plant in Nederland en/of België te koop zijn, of waarvan de zaden in Europa gekocht kunnen worden. Naast winterharde planten die het hele jaar buiten kunnen blijven staan, hebben we ook planten aan de tabel toegevoegd die in de winter binnen gezet moeten worden wanneer de nachttemperatuur onder de 10 tot 15 graden Celsius uit komt. Doordat deze planten uit zeer zonnige gebieden komen, zullen deze planten vaak wel onder een sterke kweeklamp gezet moeten worden wanneer ze binnen staan.
* 000 = onbekende waarde.
Groenteplanten die samenwerken met stikstofbindende bacteriën
In de moestuin zijn er verschillende planten te vinden die samenwerken met stikstofbindende bacteriën. De meest bekende zijn erwten-, tuinbonen-, sperziebonen-, en snijbonen planten. Op dit moment wordt het “afval” van deze planten na de oogst vaak nog in de GFT bak of op de composthoop gegooid. Dit is zonde, want ondanks dat compost veel voor de grond kan betekenen, heeft het vaak weinig effect op de hoeveelheid ammonium en nitraat in de bodem. Door de resten van deze planten door de grond te mengen, worden de goede micro-organismen die in de grond leven gevoed en wordt het stikstofgehalte van de bodem op een natuurlijke manier verhoogd.


Het gebruik van resten van groenteplanten die samenwerken met stikstofbindende bacteriën als stikstofrijke plantenvoeding is niet moeilijk. In plaats van de planten uit de grond te trekken en weg te gooien na de laatste oogst, meng je ze met een hark of schoffel door de bovenste tien centimeter van de grond. Het is belangrijk dat het grootste deel van de oude planten bedekt is met grond, zodat het gebrek aan licht en de schade door het husselen er voor zorgt dat de planten afsterven. Als de planten eenmaal door de grond zijn gemengd, dan beginnen de micro-organismen in de bodem met de resten af te breken.




In de tabel hieronder kun je het stikstofpercentage van een groot aantal groenteplanten die samenwerken met stikstofbindende bacteriën vinden. Afhankelijk van de temperatuur en vochtigheid van de bodem komt ongeveer de helft van de stikstof die in de plant opgeslagen zit binnen één tot zes maanden vrij. De andere helft van de stikstof die in de resten zit opgeslagen komt in een periode van vele jaren vrij.
Doordat er veel factoren invloed hebben op de hoeveelheid stikstof die de bacteriën kunnen binden, zoals het ras van de plant, de bodem samenstelling, het klimaat, en het moment waarop de resten door de grond worden gewerkt, kan het zijn dat de resten van jouw specifieke groenteplanten een andere hoeveelheid stikstof bevatten dan in de tabel staat of een andere verhouding hebben tussen de hoeveelheid koolstof- en stikstofdeeltjes. Het is daarom belangrijk om niet blind af te gaan op de stikstof percentages uit de tabel om in te schatten hoeveel stikstof de plantenresten aan de bodem toevoegen. Het is belangrijk om de planten die afhankelijk zijn van stikstofrijke plantenvoeding regelmatig te controleren op signalen dat ze te weinig stikstof opnemen, zoals gele bladeren en een geremde groei. Ook is het aan te raden om regelmatig het stikstofgehalte van de bodem te testen met een speciale bodemtest.
| NAAM PLANT ⬍ | % STIKSTOF IN RESTEN ⬍ | % FOSFOR IN RESTEN ⬍ | % KALIUM IN RESTEN ⬍ | C:N RATIO ⬍ | IDEALE PH WAARDE ⬍ | VERKOOPPUNTEN |
|---|---|---|---|---|---|---|
| Lupine (Lupinus spp.) | 2 | 0 | 1 | 27 | 4.5 - 7.0 |
Lupinus x russelli (plant) Lupinus angustifolius (zaden) |
| Sojaboon (Glycine max) | 2 | 0 | 1 | 24 | 5.5 - 7.5 |
Glycine max (zaden) Glycine max (zaden) |
| Kikkererwt (Cicer aretinum) | 2 | 000 | 000 | 24 | 6.0 - 8.5 | Cicer aretinum (zaden) |
| Duivenerwt (Cajanus spp.) | 3 | 000 | 000 | 14 | 4.5 - 8.0 | Cajanus cajan (zaden) |
| Bonen (Phaseolus spp.) | 2 | 0 | 1 | 19 | 6.0 - 7.5 |
Phaseolus
vulgaris (zaden) Phaseolus vulgaris (zaden) Phaseolus lunatus (zaden) Phaseolus acutifolius (zaden) |
| Erwten (Pisum spp.) | 2 | 0 | 1 | 33 | 5.5 - 8.0 |
Pisum sativum
(zaden) Pisum sativum (zaden) |
| Linzen (Lens spp.) | 2 | 000 | 000 | 25 | 5.5 - 8.0 |
Lens culinaris (zaden) Lens culinaris (zaden) |
| Pinda (Arachis hypogaea) | 2 | 000 | 000 | 22 | 4.5 - 7.0 |
Arachis hypogaea (zaden) Arachis hypogaea (zaden) Arachis hypogaea (zaden) |
| Mungbonen (Vigna ratiato) | 3 | 000 | 000 | 15 | 5.0 - 7.5 |
Vigna radiata (zaden) Vigna radiata (zaden) |
| Kouseband (Vigna unguiculata) | 2 | 000 | 000 | 22 | 5.0 - 6.0 |
Vigna unguiculata (zaden) Vigna unguiculata (zaden) |
| Tuinboon (Vica faba) | 2 | 000 | 000 | 18 | 5.5 - 8.0 | Vica faba (zaden) |
| Kittelbloem (Clitoria spp.) | 3 | 0 | 2 | 15 | 5.5 - 8.0 |
Clitoria Ternatea (zaden) Clitoria ternatea (zaden) |
| Fenugriek (Trigonella foenum-graecum) | 2 | 000 | 000 | 000 | 8.0 - 8.5 |
Trigonella foenum-graceum (zaden) |
| Hyacint boon (Lablab spp.) | 3 | 0 | 1 | 17 | 5.0 - 7.5 |
Lablab purpureus (zaden) Lablab purpureus (zaden) |
* 000 = onbekende waarde.
Overige planten die samenwerken met stikstofbindende bacteriën
Naast bomen, struiken en groenteplanten zijn er nog veel meer planten die samenwerken met stikstofbindende bacteriën. De meeste van deze planten worden door hobbykwekers gezien als sierplanten, omdat ze mooie bloemen krijgen. Een groot deel van deze mooie planten die samenwerken met stikstofbindende bacteriën worden verkocht onder de noemer “groenbemester”. Dit komt, omdat ze vaak door professionele(re) kwekers worden gekweekt om het stikstofgehalte van de bodem te verhogen. Dat de planten mooie bloemen krijgen, is voor deze kwekers niet zo belangrijk. Zolang je zaden gebruikt van een soort en een ras dat je graag wilt kweken, maakt het voor het eindresultaat dus niet uit of het verkocht wordt als sierplant of als groenbemester.


Bij het kweken van sierplanten en groenbemesters die samenwerken met stikstofbindende bacteriën kun je vaak kiezen uit twee manieren om de planten te gebruiken om het stikstofgehalte van de bodem te verhogen. Je kunt de hele planten door de bodem mengen, net als bij de groenteplanten die samenwerken met stikstofbindende bacteriën. Bij deze methoden sterven de planten af en kun je andere planten op dezelfde plek kweken. Een andere optie is om een deel van de plant af te knippen of te maaien en alleen dit afval door de grond te mengen. Dit laatste wordt vooral gedaan bij meerjarige planten, die de winter kunnen overleven. Na de winter groeien de planten dan gewoon weer door, en kun je weer genieten van de mooie bloemen.
De manier waarop en het tijdstip waarop de resten van sierplanten en groenbemesters worden gebruikt om het stikstofgehalte van de bodem te verhogen heeft invloed op het stikstof percentage van de planten. Het is daarom belangrijk om de waardes in de onderstaande tabel met een korreltje zout te nemen, en regelmatig het stikstofgehalte van de bodem te testen. Op die manier kun je voorkomen dat andere planten die niet samenwerken met stikstofbindende bacteriën, en dus afhankelijk zijn van stikstofrijke plantenvoeding, last hebben van een stikstof tekort.
| NAAM PLANT ⬍ | % STIKSTOF IN RESTEN ⬍ | % FOSFOR IN RESTEN ⬍ | % KALIUM IN RESTEN ⬍ | C:N RATIO ⬍ | IDEALE PH WAARDE ⬍ | GRAM ZADEN PER M² ⬍ | ZAAI MAANDEN ⬍ | VERKOOPPUNTEN |
|---|---|---|---|---|---|---|---|---|
| Rolklaver (Lotus spp.) | 3 | 000 | 000 | 19 | 6.0 - 8.0 | 1 | juni tot september | Lotus Corniculatus (plant) |
| Crotalaria (Crotalaria spp.) | 2 | 0 | 1 | 25 | 5.0 - 8.5 | 6 | juni tot juli |
Crotalaria verrucosa (zaden) Crotalaria juncea (zaden) |
| Esparcette (Onobrychis spp.) | 2 | 000 | 000 | 19 | 6.0 - 8.0 | 7 | april tot mei | Onobrychis viciifolia (zaden) |
| Rode klaver (Trifolium pratense) | 3 | 000 | 000 | 16 | 6.0 - 7.0 | 1.5 | maart tot mei, augustus | Trifolium pratense (zaden) |
| Witte klaver (Trifolium repens) | 4 | 0 | 000 | 20 | 6.0 - 7.5 | 1 | maart tot mei, augustus |
Trifolium repens (zaden) Trifolium repens (zaden) |
| Wikke (Vicia spp.) | 6 | 1 | 2 | 8 | 6.0 - 8.0 | 8.5 | maart tot mei, september |
Vicia sativa (zaden) Vicia sativa (zaden) |
| Serradella (Ornithopus spp.) | 2 | 0 | 3 | 22 | 4.5 - 7.0 | 0.5 | maart tot mei | |
| Honingklaver (Melilotus spp.) | 2 | 000 | 000 | 19 | 5.5 - 8.0 | 1.5 | maart tot mei, augustus |
Melilotus Officinalis (zaden) Melilotus albus (zaden) |
| Desmodium (Desmodium spp.) | 2 | 0 | 2 | 27 | 4.5 - 8.0 | 1 | april tot juli |
Desmodium adscendens (zaden) Desmodium gyrans (zaden) |
| Geitenruit (Galega spp.) | 3 | 000 | 000 | 15 | 4.0 - 8.0 | 2 | mei tot juli |
Galega
officinalis (plant) Galega officinális (zaden) |
| Zilverkruid (Dryas spp.) | 2 | 000 | 000 | 27 | 3.0 - 8.0 | 000 | oktober tot februari |
Dryas
suendermannii (plant) Dryas octopetala (plant) |
| Wondklaver (Anthyllis spp.) | 4 | 0 | 1 | 17 | 6.0 - 8.0 | 1 | juli tot oktober | Anthyllis vulneraria (zaden) |
| Incaraatklaver (Trifolium incarnatum) | 2 | 000 | 000 | 13 | 5.5 - 7.0 | 1.5 | maart tot mei, augustus | Trifolium incarnatum (zaden) |
| Pronkerwt (Lathyrus spp.) | 2 | 0 | 2 | 10 | 6.0 - 7.5 | 8 | april tot juli |
Lathyrus odoratus (zaden) Lathyrus vernus (zaden) Lathyrus latifolius (zaden) |
| Flueelboon (Mucuna spp.) | 2 | 0 | 1 | 15 | 000 | 4 | onbekend | Mucuna pruriens (zaden) |
| Luzerne (Medicago Sativa) | 2 | 000 | 000 | 19 | 6.5 - 8.0 | 2 | maart tot mei, augustus | Medicago sativa (zaden) |
* 000 = onbekende waarde.
Waterplanten die samenwerken met stikstofbindende blauwalgen
De meeste planten die op of onder water leven komen, net zoals planten die op het droge leven, aan stikstof doordat natuurlijk afval van planten en dieren afgebroken wordt door micro-organismen. Een uitzondering hierop zijn kroosvaren planten die tot het Azolla geslacht horen. Deze planten, die op kleine varens lijken, werken samen met de blauwalg Anabaena. Deze algen kunnen net als stikstofbindende bacteriën stikstofgas uit de lucht omzetten in ammonium. Onder de juiste omstandigheden kunnen de Anabaena algen meer stikstof per dag per vierkante meter fixeren dan Rhizobium bacteriën die samenwerken met planten uit de Vlinderbloemenfamilie.
Azolla planten groeien meestal erg snel. Wanneer je een vijver hebt, dan kun je overwegen om hier kroosvaren in te zetten. Wanneer de planten voldoende gegroeid zijn, kun je een deel van de kroosvaren op schepen en door de grond mengen. Doordat de planten een laag koolstof:stikstof ratio hebben van 10:1 en een totaal stikstof percentage van ongeveer 4% wordt het stikstofgehalte van de grond binnen een korte tijd na het toevoegen van het kroosvaren aan de grond verhoogd.
Vragen en Opmerkingen
Het zelf kweken van groenten, fruit, kruiden en bloemen gaat meestal gemakkelijk, maar soms zit er ook wel eens wat tegen. Mocht je een vraag hebben over het kweken van planten, dan zullen wij deze zo goed mogelijk proberen te beantwoorden. Je kunt je vragen onderaan deze pagina stellen, via het Disqus formulier. Om naar het Disqus formulier te gaan, klik je op de “Stel een vraag!”-knop hieronder.
Bronnen en verder lezen
- Abay, A. (2018). Nitrogen release dynamics of Erythrina abyssinica and Erythrina brucei litters as influenced by their biochemical composition. African Journal of Plant Science, 12(12), 331-340.
- Abbasi, M. K., Tahir, M. M., Sabir, N., & Khurshid, M. (2015). Impact of the addition of different plant residues on nitrogen mineralization-immobilization turnover and carbon content of a soil incubated under laboratory conditions. Solid Earth, 6(1), 197.
- Aher, G., Cihacek, L. J., & Cooper, K. (2017). An evaluation of C and N on fresh and aged crop residue from mixed long-term no-till cropping systems. Journal of Plant Nutrition, 40(2), 177-186.
- Al-Ain, F., Al-Chamma'a, M., & Kurdali, F. (2017). Effects of alternate irrigation with saline and non-saline water on sorghum crop manured with Elaeagnus angustifolia leaves using 15N. The Open Agriculture Journal, 11(1).
- Allard, M., & Moreau, G. (1986). Leaf decomposition in an experimentally acidified stream channel. Hydrobiologia, 139(2), 109-117.Allard, M., & Moreau, G. (1986). Leaf decomposition in an experimentally acidified stream channel. Hydrobiologia, 139(2), 109-117.
- Ambrosano, E. J., Trivelin, P. C. O., Cantarella, H., Ambrosano, G. M. B., & Muraoka, T. (2003). Nitrogen mineralization in soils amended with sunnhemp, velvet bean and common bean residues. Scientia Agricola, 60(1), 133-137.
- Al-Sagheer, A. A., El-Hack, A., Mohamed, E., Alagawany, M., Naiel, M. A., Mahgoub, S. A., ... & Swelum, A. A. (2019). Paulownia leaves as a new feed resource: Chemical composition and effects on growth, carcasses, digestibility, blood biochemistry, and intestinal bacterial populations of growing rabbits. Animals, 9(3), 95.
- Arce, M. D. L. R., Gale, S. L., & Maxted, N. (2008). A taxonomic study of Albizia (Leguminosae: Mimosoideae: Ingeae) in Mexico and Central America. In Anales del Jardín Botánico de Madrid (Vol. 65, No. 2, pp. 255-305). Consejo Superior de Investigaciones Científicas.
- Argel M, P. J., Lascano, C. E., & Ramírez, L. (1998). Leucaena in Latin American farming systems: Challenges for development.
- Arias, R., & Macqueen, D. J. (1996). Traditional uses and potential of the genus Calliandra in Mexico and Central America. In Workshop hosted by Winrock International Institute for Agricultural Development from January (Vol. 23, p. 27).
- Askegaard, M., & Eriksen, J. (2007). Growth of legume and nonlegume catch crops and residual‐N effects in spring barley on coarse sand. Journal of Plant Nutrition and Soil Science, 170(6), 773-780.
- Atallah, T., & Lopez-Real, J. M. (1991). Potential of green manure species in recycling nitrogen, phosphorus and potassium. Biological Agriculture & Horticulture, 8(1), 53-65.
- Athar, M. (2005). Nodulation of native legumes in Pakistani rangelands. Agriculturae Conspectus Scientificus, 70(2), 49-54.
- Aulakh, M. S., Walters, D. T., Doran, J. W., Francis, D. D., & Mosier, A. R. (1991). Crop residue type and placement effects on denitrification and mineralization. Soil Science Society of America Journal, 55(4), 1020-1025.
- Balkcom, K. S., Wood, C. W., Adams, J. F., & Wood, B. H. (2004). Composition and decomposition of peanut residues in Georgia. Peanut Science, 31(1), 6-11.
- Babar, K. H. A. N., Ablimit, A., Mahmood, R., & Qasim, M. (2010). Robinia pseudoacacia leaves improve soil physical and chemical properties. 干旱区科学, 2(4), 266-271.
- Balasankar, D., Vanilarasu, K., Selva Preetha, P., Rajeswari, S. M. U., & Debjit, B. (2013). Senna–A medical miracle plant. Journal of medicinal plants studies, 1(3), 41-47.
- Berry, P. M., Sylvester‐Bradley, R., Philipps, L., Hatch, D. J., Cuttle, S. P., Rayns, F. W., & Gosling, P. (2002). Is the productivity of organic farms restricted by the supply of available nitrogen?. Soil Use and Management, 18, 248-255.
- BHATTA, B. K., OSONO, T., & TAKEDA, H. (2017). Carbohydrate Control of Nitrogen Dynamics in Decomposing Leaf Litter of Temperate Tree Species. 同志社大学ハリス理化学研究報告= The Harris science review of Doshisha University, 58(3), 118-125.
- Blackshaw, R. E., Moyer, J. R., Doram, R. C., & Boswell, A. L. (2001). Yellow sweetclover, green manure, and its residues effectively suppress weeds during fallow. Weed science, 49(3), 406-413.
- Biederbeck, V. O., Bouman, O. T., Campbell, C. A., Winkleman, G. E., & Bailey, L. D. (1996). Nitrogen benefits from four green-manure legumes in dryland cropping systems. Canadian Journal of Plant Science, 76(2), 307-315.
- Bishopp, A., & Bennett, M. J. (2019). Turning lateral roots into nodules. Science, 366(6468), 953-954.
- Bista, B., & Dahal, S. (2018). Cementing the Organic Farming by Green Manures. International Journal of Applied Sciences and Biotechnology, 6(2), 87-96.
- Brakie, M.,. (2010). Plant fact sheet for eastern redbud (Cercis canadensis). USDA-Natural Resources Conservation Service, East Texas Plant Materials Center. Nacogdoches, TX 75964
- Brito, L. M., Reis, M., Mourão, I., & Coutinho, J. (2014). Evaluation of invasive Acacia species compost as alternative horticultural organic substrates. Building Organic Bridges, 3, 929-932.
- Brock, J. L. (1973). Growth and nitrogen fixation of pure stands of three pasture legumes with high/low phosphate. New Zealand journal of agricultural research, 16(4), 483-491.
- Büchi, L., Gebhard, C. A., Liebisch, F., Sinaj, S., Ramseier, H., & Charles, R. (2015). Accumulation of biologically fixed nitrogen by legumes cultivated as cover crops in Switzerland. Plant and Soil, 393(1-2), 163-175.
- Budelman, A. (1988). The performance of the leaf mulches of Leucaena leucocephala, Flemingia macrophylla and Gliricidia sepium in weed control. Agroforestry Systems, 6(1-3), 137-145.
- Burton, J. C. (1970). Nodulation and symbiotic nitrogen fixation by prairie legumes. In Proceedings of the second Midwest Prairie conference (pp. 18-20).
- Caamal‐Maldonado, J. A., Jiménez‐Osornio, J. J., Torres‐Barragán, A., & Anaya, A. L. (2001). The use of allelopathic legume cover and mulch species for weed control in cropping systems. Agronomy journal, 93(1), 27-36.
- Cabrera, M. L., Kissel, D. E., & Vigil, M. F. (2005). Nitrogen mineralization from organic residues: research opportunities. Journal of environmental quality, 34(1), 75-79.
- Calegari, A. (2003). Cover crop management. In Conservation Agriculture (pp. 191-199). Springer, Dordrecht.
- Castro-Díez, P., González-Muñoz, N., Alonso, A., Gallardo, A., & Poorter, L. (2009). Effects of exotic invasive trees on nitrogen cycling: a case study in Central Spain. Biological Invasions, 11(8), 1973-1986.
- Cao, Y., & Chen, Y. (2017). Coupling of plant and soil C: N: P stoichiometry in black locust (Robinia pseudoacacia) plantations on the Loess Plateau, China. Trees, 31(5), 1559-1570.
- Clúa, J., Roda, C., Zanetti, M. E., & Blanco, F. A. (2018). Compatibility between legumes and rhizobia for the establishment of a successful nitrogen-fixing symbiosis. Genes, 9(3), 125.
- Chaer, G. M., Resende, A. S., Campello, E. F. C., de Faria, S. M., & Boddey, R. M. (2011). Nitrogen-fixing legume tree species for the reclamation of severely degraded lands in Brazil. Tree Physiology, 31(2), 139-149.
- Chang, H., Chen, P., & Ma, M. (2020). Feeding preference of Altica deserticola for leaves of Glycyrrhiza glabra and G. uralensis and its mechanism. Scientific Reports, 10(1), 1-8.
- Chatarpaul, L., & Carlisle, A. (1983). Nitrogen fixation: a biotechnological opportunity for Canadian forestry. The Forestry Chronicle, 59(5), 249-259.
- CIAFRÉ, C. An artificially disjunct population of coastal indigo, Indigofera miniata (Fabaceae), new to Missouri. Missouriensis, 8.
- Cobo, J. G., Barrios, E., Kass, D. C. L., & Thomas, R. J. (2002). Decomposition and nutrient release by green manures in a tropical hillside agroecosystem. Plant and soil, 240(2), 331-342.
- Collins, A. S., Chase, C. A., Stall, W. M., & Hutchinson, C. M. (2008). Optimum densities of three leguminous cover crops for suppression of smooth pigweed (Amaranthus hybridus). Weed science, 753-761.
- Cooper, J. E., & Scherer, H. W. (2012). Nitrogen Fixation. Marschner’s Mineral Nutrition of Higher Plants, 389–408. doi:10.1016/b978-0-12-384905-2.00016-9
- Davison, V. E. (1945). Wildlife values of the lespedezas. The Journal of Wildlife Management, 9(1), 1-9.
- Dawson, J. O., & Funk, D. T. (1981). Seasonal change in foliar nitrogen concentration of Alnus glutinosa. Forest Science, 27(2), 239-243.
- De Boever, M., Gabriels, D., Ouessar, M., & Cornelis, W. (2014). Influence of Acacia trees on soil nutrient levels in arid lands. EGUGA, 15995.
- de Kort, I., & Thijsse, G. (1984). A revision of the genus Indigofera. Blumea, 30(1), 89-151.
- Denison, R. F. (2000). Legume sanctions and the evolution of symbiotic cooperation by rhizobia. The American Naturalist, 156(6), 567-576.
- de Sousa, F. F., do Carmo, D. L., de Souza Carneiro, J. E., Urquiaga, S., & Santos, R. H. S. (2016). Legumes as green manure for common bean cultivated in two growing seasons at southeast Brazil. African Journal of Agricultural Research, 11(49), 4953-4958.
- de Souza, É. R., Lewis, G. P., Forest, F., Schnadelbach, A. S., van den Berg, C., & de Queiroz, L. P. (2013). Phylogeny of Calliandra (Leguminosae: Mimosoideae) based on nuclear and plastid molecular markers. Taxon, 62(6), 1200-1219.
- Devi, M., Ariharan, V. N., & Prasad, P. N. (2013). Nutritive value and potential uses of Leucaena leucocephala as biofuel-A mini review. Research Journal of Pharmaceutical, Biological and Chemical Sciences, 4(1), 515-521.
- Domenach, A. M., Moiroud, A., & Jocteur-Monrozier, L. (1994). Leaf carbon and nitrogen constituents of some actinorhizal tree species. Soil Biology and Biochemistry, 26(5), 649-653.
- dos Reis Jr, F. B., Simon, M. F., Gross, E., Boddey, R. M., Elliott, G. N., Neto, N. E., ... & Norén, A. (2010). Nodulation and nitrogen fixation by Mimosa spp. in the Cerrado and Caatinga biomes of Brazil. New Phytologist, 186(4), 934-946.
- Drew, E., Herridge, D., Ballard, R., O’Hara, G., Deaker, R., Denton, M., ... & Seymour, N. (2012). Inoculating legumes: a practical guide. Grains Research and Development Corporation.
- Dreyfus, B., Diem, H. G., Freire, J., Keya, S. O., & Dommergues, Y. R. (1987). Nitrogen fixation in tropical agriculture and forestry. Microbial technology in the developping world. Oxford University Press, Oxford, 1-7.
- Dupont, L., Hérouart, D., Alloing, G., Hopkins, J., Pierre, O., Frendo, P., & El Msehli, S. (2012). The legume root nodule: from symbiotic nitrogen fixation to senescence (p. 850). London: INTECH Open Access Publisher.
- Erickson, H. E., Soto, P., Johnson, D. W., Roath, B., & Hunsaker, C. (2005). Effects of vegetation patches on soil nutrient pools and fluxes within a mixed-conifer forest. Forest science, 51(3), 211-220.
- Finzi, A. C., Allen, A. S., DeLucia, E. H., Ellsworth, D. S., & Schlesinger, W. H. (2001). Forest litter production, chemistry, and decomposition following two years of free‐air CO2 enrichment. Ecology, 82(2), 470-484.
- Fox, J. E., Gulledge, J., Engelhaupt, E., Burow, M. E., & McLachlan, J. A. (2007). Pesticides reduce symbiotic efficiency of nitrogen-fixing rhizobia and host plants. Proceedings of the National Academy of Sciences, 104(24), 10282-10287.
- Franche, C., Lindström, K., & Elmerich, C. (2009). Nitrogen-fixing bacteria associated with leguminous and non-leguminous plants. Plant and soil, 321(1-2), 35-59.
- Gaisie, E., Sadick, A., Agyeman, K., Adjei-Gyapong, T., & Quansah, G. (2016). Leaf Decomposition and the Nutrients Release from Multipurpose Trees for Crop Production. International Journal of Scientific Research in Science, Engineering and Technology, 2(1), 345-354.
- Gan, Y. T., Liang, B. C., Liu, L. P., Wang, X. Y., & McDonald, C. L. (2011). C: N ratios and carbon distribution profile across rooting zones in oilseed and pulse crops. Crop and Pasture Science, 62(6), 496-503.
- Geneve, R. L. (1991). Eastern redbud (Cercis canadensis L.) and judas tree (Cercis siliquastrum L.). In Trees III (pp. 142-151). Springer, Berlin, Heidelberg.
- Gilman, E. F., & Watson, D. G. (1993). Albizia julibrissin. Fact Sheet ST-68. University of Florida, Gainesville.
- Gilman, F. & Watson, D.G. (1993). Calliandra haematocephala: Powderpuff. ENH267/ST108.
- Goldstein, C. L., Williard, K. W., Schoonover, J. E., Baer, S. G., Groninger, J. W., & Snyder, J. M. (2010). Soil and groundwater nitrogen response to invasion by an exotic nitrogen‐fixing shrub. Journal of environmental quality, 39(3), 1077-1084.
- Gomes Júnior, D., Caldeira, M. V. W., Klippel, V. H., Mendonça, E. D. S., Delarmelina, W. M., Godinho, T. D. O., & Rocha, R. L. F. (2019). Decomposition of Leaf Litter in Semideciduous Submontane Forest, in The Southern State of Espírito Santo. Floresta e Ambiente, 26(SPE1).
- Gutschick, V. P. (1978). Energy and nitrogen fixation. BioScience, 28(9), 571-575.
- Haines, S. G., & DeBell, D. S. (1979). Use of nitrogen-fixing plants to improve and maintain productivity of forest soils. Reprints-United States, Forest Service.
- Handi, Y. A. (1982). Application of nitrogen fixing systems in soil management (No. 631.46 F3). FAO.
- Hayward, R. (2004). The Acacia tree: A sustainable resource for Africa.
- Hendricks, J. J., & Boring, L. R. (1992). Litter quality of native herbaceous legumes in a burned pine forest of the Georgia Piedmont. Canadian Journal of Forest Research, 22(12), 2007-2010.
- Hopkins, M. (2015, February). Cercis, Its Taxonomic Relationship in the Oklahoma Flora. In Proceedings of the Oklahoma Academy of Science (Vol. 22, pp. 130-131).
- Horodecki, P., & Jagodziński, A. M. (2019). Site Type Effect on Litter Decomposition Rates: A Three-Year Comparison of Decomposition Process between Spoil Heap and Forest Sites. Forests, 10(4), 353.
- Hosseini, V., Azizi, P., & Hoseini, S. M. (2004, September). Determining rate of litter decomposition of Alnus subcordata in Asalem and Vaz region by C/N index under laboratory conditions. In Euro Soil.
- Hossain, Md. (2001). Albizia odoratissima: Tea shade tree. NFTA-95-01.
- Huang, J., Wang, P., Niu, Y., Yu, H., Ma, F., Xiao, G., & Xu, X. (2018). Changes in C: N: P stoichiometry modify N and P conservation strategies of a desert steppe species Glycyrrhiza uralensis. Scientific reports, 8(1), 1-9.
- Hui, A. N., & Shangguan, Z. (2010). Leaf stoichiometric trait and specific leaf area of dominant species in the secondary succession of the Loess Plateau. Pol. J. Ecol, 58(1), 103-113.
- Hume, L. J., Withers, N. J., & Rhoades, D. A. (1985). Nitrogen fixation in sainfoin (Onobrychis viciifolia) 2. Effectiveness of the nitrogen-fixing system. New Zealand journal of agricultural research, 28(3), 337-348.
- Ibáñez, F., Wall, L., & Fabra, A. (2017). Starting points in plant-bacteria nitrogen-fixing symbioses: intercellular invasion of the roots. Journal of Experimental Botany, 68(8), 1905-1918.
- Innangi, M., Danise, T., d’Alessandro, F., Curcio, E., & Fioretto, A. (2017). Dynamics of organic matter in leaf litter and topsoil within an Italian alder (Alnus cordata (Loisel.) Desf.) ecosystem. Forests, 8(7), 240.
- Isely, D. (1982). Leguminosae and Homo sapiens. Economic Botany, 36(1), 46-70.
- Jat, R. S., Reddy, R. N., Bansal, R., & Manivel, P. Good Agriculture Practices for Senna. Extension Bulletin.
- Jaroszewska, A., & Biel, W. (2017). Chemical composition and antioxidant activity of leaves of mycorrhized sea-buckthorn (Hippophae rhamnoides L.). Chilean journal of agricultural research, 77(2), 155-162.
- Jiang, X., Hu, Y., Han, J., & Zhou, Y. (2014). Effects of warming on carbon, nitrogen and phosphorus stoichiometry in tundra soil and leaves of typical plants. Chinese Journal of Plant Ecology, 38(9), 941-948.
- Júnior, J. R. R., Botelho, R. V., Trevizam, A. R., Müller, M. M., Bendassolli, J. A., & Rombolà, A. D. (2014). Potential use of winter green manure species for nitrogen recycling by ‘Niagara Rosada’grapevines. Ciência e Técnica Vitivinícola, 29(2), 44-52.
- Kakraliya, S. K., Singh, U., Bohra, A., Choudhary, K. K., Kumar, S., Meena, R. S., & Jat, M. L. (2018). Nitrogen and legumes: a meta-analysis. In Legumes for Soil Health and Sustainable Management (pp. 277-314). Springer, Singapore.
- Kalburtji, K. L., Mamolos, A. P., & Kostopoulou, S. K. (1998). Litter dynamics of Dactylis glomerata and Vicia villosa with respect to climatic and soil characteristics. Grass and forage science, 53(3), 225-232.
- Kang, H., Xin, Z., Berg, B., Burgess, P. J., Liu, Q., Liu, Z., ... & Liu, C. (2010). Global pattern of leaf litter nitrogen and phosphorus in woody plants. Annals of forest science, 67(8), 811.
- Kiers, E. T., Rousseau, R. A., West, S. A., & Denison, R. F. (2003). Host sanctions and the legume–rhizobium mutualism. Nature, 425(6953), 78-81.
- Kim, J. S. (2007). Litter decomposition and nitrogen release in three quercus species at temperate broad‐leaved forest. Forest Science and Technology, 3(2), 123-131.
- Kirov, V., Shindarska, Z., Kostadinova, G., Gencheva, A., Hadgiev, S., Penev, T., & Baykov, B. (2014). Comparative study of new energy crops for the production of biogas. Int J Curr Microbiol App Sci, 3(11), 181-188.
- Knepp, R. G., Hamilton, J. G., Mohan, J. E., Zangerl, A. R., Berenbaum, M. R., & DeLucia, E. H. (2005). Elevated CO2 reduces leaf damage by insect herbivores in a forest community. New Phytologist, 167(1), 207-218.
- Koenig, R. T., & Cochran, V. L. (1994). Decomposition and nitrogen mineralization from legume and non-legume crop residues in a subarctic agricultural soil. Biology and fertility of soils, 17(4), 269-275.
- Kolapo, O. K., Wahab, M. K. A., Hossain, A., Adebola, A. O., & Shukor, N. A. A. (2014). Effects of Albizia saman (Jacq. Mull) leaf mulch on vegetative growth of maize (Zea mays L.) and soil chemical properties through biomass transfer. Research on Crops, 15(4), 768-774.
- Krishna, M. P., & Mohan, M. (2017). Litter decomposition in forest ecosystems: a review. Energy, Ecology and Environment, 2(4), 236-249.
- Kumar, S., Meena, R. S., Datta, R., Verma, S. K., Yadav, G. S., Pradhan, G., ... & Mashuk, H. A. (2020). Legumes for carbon and nitrogen cycling: An organic approach. In Carbon and Nitrogen Cycling in Soil (pp. 337-375). Springer, Singapore.
- Kumar, P., & Mishra, P. K. Cultivation of Gliricidia sepium (Gliricidia) and its use for improving soil fertility.
- Kumar, A., & Kumar, A. Diversity of Flemingia and their importance in lac cultivation.
- Kumari, B. S., Ram, M. R., & Mallaiah, K. V. (2010). Studies on nodulation, biochemical analysis and protein profiles of Rhizobium isolated from Indigofera species. Malaysian Journal of Microbiology, 6(2), 133-139.
- Kwabiah, A. B., Stoskopf, N. C., Voroney, R. P., & Palm, C. A. (2001). Nitrogen and Phosphorus Release from Decomposing Leaves under Sub‐Humid Tropical Conditions 1. Biotropica, 33(2), 229-240.
- Laamouri, A., Elaloui, M., Ennajah, A., & Bouabdelly, N. (2015). Study of mineral and nutritional components of some leguminous herbaceous and shrubs species in Tunisia. IJAAR, 6(4), 1-7.
- Lai, W. C., Tsui, Y. T., Singab, A. N. B., El-Shazly, M., Du, Y. C., Hwang, T. L., ... & Wu, Y. C. (2013). Phyto-SERM constitutes from Flemingia macrophylla. International journal of molecular sciences, 14(8), 15578-15594.
- Lee, Y. C., Nam, J. M., & Kim, J. G. (2011). The influence of black locust (Robinia pseudoacacia) flower and leaf fall on soil phosphate. Plant and soil, 341(1-2), 269-277.
- Li, X., Sun, K., & Li, F. Y. (2014). Variation in leaf nitrogen and phosphorus stoichiometry in the nitrogen-fixing Chinese sea-buckthorn (Hippophae rhamnoides L. subsp. sinensis Rousi) across northern China. Ecological research, 29(4), 723-731.
- Liu, C. A., Nie, Y., Zhang, Y. M., Tang, J. W., & Siddique, K. H. (2018). Introduction of a leguminous shrub to a rubber plantation changed the soil carbon and nitrogen fractions and ameliorated soil environments. Scientific Reports, 8(1), 1-11.
- Lindemann, W. C., & Glover, C. R. (2003). Nitrogen fixation by legumes.
- Lumpkin, T. A., & Plucknett, D. L. (1985). Azolla, a low cost aquatic green manure for agricultural crops. Congress of the US Office of Technology Assessment.
- Lupwayi, N. Z., & Soon, Y. K. (2015). Carbon and nitrogen release from legume crop residues for three subsequent crops. Soil Science Society of America Journal, 79(6), 1650-1659.
- Lynch, M. J., Mulvaney, M. J., Hodges, S. C., Thompson, T. L., & Thomason, W. E. (2016). Decomposition, nitrogen and carbon mineralization from food and cover crop residues in the central plateau of Haiti. Springerplus, 5(1), 973.
- Mafongoya, P. L., Giller, K. E., & Palm, C. A. (1998). Decomposition and nitrogen release patterns of tree prunings and litter. In Directions in Tropical Agroforestry Research (pp. 77-97). Springer, Dordrecht.
- Mafongoya, P. L., Barak, P., & Reed, J. D. (2000). Carbon, nitrogen and phosphorus mineralization of tree leaves and manure. Biology and Fertility of soils, 30(4), 298-305.
- Mazzoncini, M., Bàrberi, P., Cerrai, D., Rinaudo, V., & Belloni, P. (2004). Effects of green manure on soil nitrogen availability and crop productivity in a Mediterranean organic farming system. Abstracts Eurosoil, 446.
- McCormick, K. M., Norton, R. M., Peoples, M. B., & Eagles, H. A. (2001, January). Fenugreek (Trigonella foenum graecum) compared to five temperate legume species in Wimmera farming systems. In Proceedings of the 10th Australian Agronomy Conference, Hobart.
- McKey, D. O. Y. L. E. (1994). Legumes and nitrogen: the evolutionary ecology of a nitrogen-demanding lifestyle. Advances in legume systematics, 5, 211-228.
- Meena, Ashvin & Meena, Ram. (2019). Nitrogen Fixing Trees: Nature’s Solution to Curing Nitrogen Deficiency.
- Miller, C. (2000). Understanding the carbon-nitrogen ratio. Acres USA, 30(4), 20-1.
- Mishra, G., Giri, K., Dutta, A., Hazarika, S., & BROGOHAIN, P. (2016). A laboratory study to validate the impact of the addition of Alnus nepalensis leaf litter on carbon and nutrients mineralization in soil. Nusantara Bioscience, 8(1).
- Moore, A. W. (1969). Azolla: biology and agronomic significance. The Botanical Review, 35(1), 17-34.
- Morris, J. B. (1997). Special-purpose legume genetic resources conserved for agricultural, industrial, and pharmaceutical use. Economic Botany, 51(3), 251-263.
- Mulvaney, M. J., Wood, C. W., Balkcom, K. S., Shannon, D. A., & Kemble, J. M. (2010). Carbon and nitrogen mineralization and persistence of organic residues under conservation and conventional tillage. Agronomy journal, 102(5), 1425-1433.
- Mulrean, E. (2010). Cold Hardiness of Dessert Trees. Arid Zone Trees, 17(1).
- Munroe, J. W., & Isaac, M. E. (2014). N 2-fixing trees and the transfer of fixed-N for sustainable agroforestry: a review. Agronomy for Sustainable Development, 34(2), 417-427.
- Nakhone, L. N., & Tabatabai, M. A. (2008). Nitrogen mineralization of leguminous crops in soils. Journal of Plant Nutrition and Soil Science, 171(2), 231-241.
- Navarrete-Tindall, N. E., Van Sambeek, J. W., Kirk, S. D., & McGraw, R. L. (1981). Adaptation of four Amorpha shrubs to four light levels. General Technical Report NC., 203.
- Nigussie, Z., & Alemayehu, G. (2013). Sesbania sesban (L.) Merrill: Potential uses of an underutilized multipurpose tree in Ethiopia. African Journal of Plant Science, 7(10), 468-475.
- Njunie, M. N., Wagger, M. G., & Luna‐Orea, P. (2004). Residue decomposition and nutrient release dynamics from two tropical forage legumes in a Kenyan environment. Agronomy Journal, 96(4), 1073-1081.
- Nkyi, K.A., Acheampong, M. (2013). Decomposition rate and chemical composition of leafy mulch of some tree species in Ghana. Ghana J. Forestry, 29(1&2), 45-59.
- Novotny, A. M., Schade, J. D., Hobbie, S. E., Kay, A. D., Kyle, M., Reich, P. B., & Elser, J. J. (2006). Stoichiometric response of nitrogen-Wxing and non-Wxing dicots to manipulations of CO.
- Novotny, A. M., Schade, J. D., Hobbie, S. E., Kay, A. D., Kyle, M., Reich, P. B., & Elser, J. J. (2006). Stoichiometric response of nitrogen-Wxing and non-Wxing dicots to manipulations of CO.
- Nyeko, P., Stewart, J., Franzel, S., & Barkland, P. (2004). Farmers experiences in the management and utilization of Calliandra calorthyrsus, a fodder shrub in Uganda. Agricultural Research and Extension Network.
- Nwachukwu, C. U. (2016). Taxonomic Evaluation of the Medicinal and Economic Values of some species of Indigofera L.(Leguminosae-Papilionoideae).
- Oakley, B. B., North, M. P., & Franklin, J. F. (2006). Facilitative and competitive effects of a N-fixing shrub on white fir saplings. Forest Ecology and Management, 233(1), 100-107.
- Oelbermann, M., Voroney, R. P., Schlönvoigt, A. M., & Kass, D. C. (2004). Decomposition of Erythrina poeppigiana leaves in 3-, 9-, and 18-year-old alleycropping systems in Costa Rica. Agroforestry systems, 63(1), 27-32.
- Old, K. M. (2002). Acacia spp (No. 20). Bioversity International.
- Oliveira, M., Rebac, D., Coutinho, J., Ferreira, L. M., & Trindade, H. (2020). Nitrogen mineralization of legume residues: interactions between species, temperature and placement in soil. Spanish journal of agricultural research, 18(1), 1101.
- Oliveira, F. R. A. D., Souza, H. A. D., Carvalho, M. A. R. D., & Costa, M. C. G. (2018). Green fertilization with residues of leguminous trees for cultivating maize in degraded soil. Revista Caatinga, 31(4), 798-807.
- Oyebamiji, N. A., Babalola, O. A., & Aduradola, A. M. (2017). Decomposition and nitrogen release patterns of Parkia biglobosa and Albizia lebbeck leaves with nitrogen fertilizer for maize production in Sudan savanna alfisol of Nigeria. Journal of Tropical Forestry and Environment, 7(1), 54-64.
- Oyun, M. B. (2006). Chemical characterization of selected tree legumes as indices for their litter quality. JApSc, 6(10), 2321-2324.
- Palm, O., Weerakoon, W. L., de Silva, M. A. P., & Rosswall, T. (1988). Nitrogen mineralization ofSesbania sesban used as green manure for lowland rice in Sri Lanka. Plant and Soil, 108(2), 201-209.
- Pandey, C. B., & Rai, R. B. (2007). Nitrogen cycling in gliricidia (Gliricidia sepium) alley cropping in humid tropics. TROPICAL ECOLOGY-ALLAHABAD-, 48(1), 87.
- Pandey, C. B., Sharma, D. K., & Bargali, S. S. (2006). Decomposition and nitrogen release from Leucaena leucocephala in central India. Tropical ecology, 47(1), 149-152.
- Pankievicz, V. C., Irving, T. B., Maia, L. G., & Ané, J. M. (2019). Are we there yet? The long walk towards the development of efficient symbiotic associations between nitrogen-fixing bacteria and non-leguminous crops. BMC biology, 17(1), 99.
- Paudel, N., Paudel, L. P., Rai, P. D., & Das, B. D. (2017). Change in physico-chemical properties of soil and nutrients in Desmodium triflorum in case of seasonal variation in Ratnanagar-11, Jirauna, Chitwan, Nepal. International Journal of Scientific Reports, 3(11), 285-287.
- Pawlowski, K., & Sirrenberg, A. (2003). Symbiosis between Frankia and actinorhizal plants: root nodules of non-legumes.
- Pérez‐Corona, M. E., Hernández, M. C. P., & de Castro, F. B. (2006). Decomposition of alder, ash, and poplar litter in a Mediterranean riverine area. Communications in soil science and plant analysis, 37(7-8), 1111-1125.
- Perry, E., & Hickman, G. W. (2001). A survey to determine the leaf nitrogen concentrations of 25 landscape tree species. Journal of Arboriculture, 27(3), 152-159.
- Philipp, D., & Jennings, J. A. (2013). Forage Lespedeza. Cooperative Extension Service, University of Arkansas, US Department of Agriculture and county governments cooperating.
- Pommeresche, R., & Hansen, S. (2017). Examining root nodule activity on legumes.
- Povilaitis, V., Šlepetienė, A., Šlepetys, J., Lazauskas, S., Tilvikienė, V., Amalevičiūtė, K., ... & Kadžiulienė, Ž. (2016). The productivity and energy potential of alfalfa, fodder galega and maize plants under the conditions of the nemoral zone. Acta Agriculturae Scandinavica, Section B—Soil & Plant Science, 66(3), 259-266.
- Prenner, G. (2004). Floral ontogeny in Lespedeza thunbergii (Leguminosae: Papilionoideae: Desmodieae): variations from the unidirectional mode of organ formation. Journal of Plant Research, 117(4), 297-302.
- Rani, K., Sharma, P., Kumar, S., Wati, L., Kumar, R., Gurjar, D. S., & Kumar, D. (2019). Legumes for Sustainable Soil and Crop Management. In Sustainable Management of Soil and Environment (pp. 193-215). Springer, Singapore.
- Rascio, N., La Rocca, N., Sven Erik, J., & Brian, F. (2008). Biological nitrogen fixation. Encyclopedia of Ecology.
- Rashid, M. H. O., Krehenbrink, M., & Akhtar, M. S. (2015). Nitrogen-fixing plant-microbe symbioses. In Sustainable agriculture reviews (pp. 193-234). Springer, Cham.
- Ribeiro-Barros, A. I., Silva, M. J., Moura, I., Ramalho, J. C., Máguas-Hanson, C., & Ribeiro, N. S. (2017). The Potential of Tree and Shrub Legumes in Agroforestry Systems. Nitrogen in Agriculture-Updates; Amanullah, K., Fahad, S., Eds, 223-239.
- Ruiz-Vega, J., Nuñez-Barrios, A., & Ma, C. R. (2010). DECOMPOSITION RATES OF INTERCROPPED GREEN MANURE CROPS IN OAXACA, MEXICO. Anadolu Tarım Bilimleri Dergisi, 25(3), 212-216.
- Robertson, K. R., (1976). Cercis: The redbuds. Arnoldia, 36(2): 37–49.
- Rodriguez, H. G., Maiti, R., Narvaez, R. I. V., & Sarkar, N. C. (2015). Carbon and nitrogen content in leaf tissue of different plant species, northeastern Mexico. International Journal of Bio-resource and Stress Management, 6(1), 113-116.
- Rogers, T. H., & Giddens, J. E. (1957). Green manure and cover crops. Soil, the yearbook of agriculture’.(Ed. A Stefferud) pp, 252-257.
- Rondon, M. A., Lehmann, J., Ramírez, J., & Hurtado, M. (2007). Biological nitrogen fixation by common beans (Phaseolus vulgaris L.) increases with bio-char additions. Biology and fertility of soils, 43(6), 699-708.
- Rosenfeld, A., & Rayns, F. (2011). Sort Out Your Soil: A practical guide to green manures.
- Rosenstock, T. S., Tully, K. L., Arias-Navarro, C., Neufeldt, H., Butterbach-Bahl, K., & Verchot, L. V. (2014). Agroforestry with N2-fixing trees: sustainable development's friend or foe?. Current Opinion in Environmental Sustainability, 6, 15-21.
- Russo, R. O. (2005). Nitrogen-fixing trees with actinorhiza in forestry and agroforestry. In Nitrogen fixation in agriculture, forestry, ecology, and the environment (pp. 143-171). Springer, Dordrecht.
- Sainju, U. M., Rahman, S., & Singh, B. P. (2001). Evaluating hairy vetch residue as nitrogen fertilizer for tomato in soilless medium. HortScience, 36(1), 90-93.
- Sakala, W. D., Cadisch, G., & Giller, K. E. (2000). Interactions between residues of maize and pigeonpea and mineral N fertilizers during decomposition and N mineralization. Soil biology and biochemistry, 32(5), 679-688.
- Santi, C., Bogusz, D., & Franche, C. (2013). Biological nitrogen fixation in non-legume plants. Annals of botany, 111(5), 743-767.
- Sayed, W. F. (2011). Improving Casuarina growth and symbiosis with Frankia under different soil and environmental conditions. Folia microbiologica, 56(1), 1-9.
- Săvulescu, E., Georgescu, M. I., Popa, V., & Luchian, V. (2018, July). Morphological and Anatomical Properties of the Senna Alexandrina Mill.(Cassia Angustifolia Vahl.). In “Agriculture for Life, Life for Agriculture” Conference Proceedings (Vol. 1, No. 1, pp. 305-310). Sciendo.
- Schlesinger, W. H., & Hasey, M. M. (1981). Decomposition of chaparral shrub foliage: losses of organic and inorganic constituents from deciduous and evergreen leaves. Ecology, 62(3), 762-774.
- Schubert, K. R. (1986). Products of biological nitrogen fixation in higher plants: synthesis, transport, and metabolism. Annual Review of Plant Physiology, 37(1), 539-574.
- Shah, J. F., Harner, M. J., & Tibbets, T. M. (2010). Elaeagnus angustifolia elevates soil inorganic nitrogen pools in riparian ecosystems. Ecosystems, 13(1), 46-61.
- Shin, C. S., Sharif, M., & Lee, H. Y. (2018). Evaluating the Effect of Bacterial Inoculation and Fertilization on the Soil Nutrient Status of Coal Mine Soil by Growing Soybean (Glycine max) and Shrub Lespedeza (Lespedeza bicolor). Sustainability, 10(12), 4793.
- Sitters, J., Edwards, P. J., & Venterink, H. O. (2013). Increases of soil C, N, and P pools along an acacia tree density gradient and their effects on trees and grasses. Ecosystems, 16(2), 347-357.
- Silas, M. N. E., Murungi, J. I., & Wanjau, R. N. (2012). Levels of macronutrients of leaves of selected plants from highlands east of Mount Kenya. International Journal of Applied, 2(9).
- Soumare, A., Diedhiou, A. G., Thuita, M., Hafidi, M., Ouhdouch, Y., Gopalakrishnan, S., & Kouisni, L. (2020). Exploiting Biological Nitrogen Fixation: A Route Towards a Sustainable Agriculture. Plants, 9(8), 1011.
- Sprent, J. I., & Raven, J. A. (1985). Evolution of nitrogen-fixing symbioses. Proceedings of the Royal Society of Edinburgh, Section B: Biological Sciences, 85(3-4), 215-237.
- Sprent, J. I., Scott, R., & Perry, K. M. (1978). The nitrogen economy of Myrica gale in the field. The Journal of Ecology, 657-668.
- Sprent, J. I., & Parsons, R. (2000). Nitrogen fixation in legume and non-legume trees. Field Crops Research, 65(2-3), 183-196.
- Sprent, J. I., Ardley, J., & James, E. K. (2017). Biogeography of nodulated legumes and their nitrogen‐fixing symbionts. New Phytologist, 215(1), 40-56.
- Sprent, J. I., & Raven, J. A. (1985). Evolution of nitrogen-fixing symbioses. Proceedings of the Royal Society of Edinburgh, Section B: Biological Sciences, 85(3-4), 215-237.
- Sprent, J. I. (2005). NITROGEN IN SOILS| Symbiotic Fixation.
- Staaf, H. (1980). Release of plant nutrients from decomposing leaf litter in a South Swedish beech forest. Ecography, 3(2), 129-136.
- Stewart, W. D. (1977). Present-day nitrogen-fixing plants. Ambio, 166-173.
- Talgre, L., Roostalu, H., Maeorg, E., & Lauringson, E. (2017). Nitrogen and carbon release during decomposition of roots and shoots of leguminous green manure crops. Agronomy Research, 15(2), 594-601.
- Talgre, L., Lauringson, E., Roostalu, H., Astover, A., & Makke, A. (2012). Green manure as a nutrient source for succeeding crops. Plant, Soil and Environment, 58(6), 275-281.
- Taha, M. E. N., Pretzsch, J., Siddig, M. E., Deafalla, T. H., & Elamin, H. M. (2018). Valuation of the Environmental Role of Acacia senegal Tree in the Gum Belt of Kordofan and the Blue Nile Sectors, Sudan. In Gum Arabic (pp. 23-28). Academic Press.
- Taleshi, S. A. R., Dhumal, K. N., Alipour, A., Espahbodi, K., & Ghasemi, O. (2009). Impact of Alder (Alnus subcordata) in fertility of forest soil. Research Journal of Environmental Sciences, 3(6), 640-644.
- Teleuță, A., & Țîței, V. (2017). Some biological peculiarities and productivity of the species Anthyllis macrocephala in Moldova. Scientific Papers-Series A, Agronomy, 60, 413-418.
- Thilakarathna, R. M. M. S., Papadopoulos, Y. A., Rodd, A. V., Gunawardena, A. N., Fillmore, S. A. E., & Prithiviraj, B. (2012). Characterizing nitrogen transfer from red clover populations to companion bluegrass under field conditions. Canadian Journal of Plant Science, 92(6), 1163-1173.
- Thippayarugs, S., Toomsan, B., Vityakon, P., Limpinuntana, V., Patanothai, A., & Cadisch, G. (2008). Interactions in decomposition and N mineralization between tropical legume residue components. Agroforestry Systems, 72(2), 137-148.
- Thomas, R. J., & Asakawa, N. M. (1993). Decomposition of leaf litter from tropical forage grasses and legumes. Soil Biology and Biochemistry, 25(10), 1351-1361.
- Timsina, J. (2018). Can organic sources of nutrients increase crop yields to meet global food demand?. Agronomy, 8(10), 214.
- Tóth, K., & Stacey, G. (2015). Does plant immunity play a critical role during initiation of the legume-rhizobium symbiosis?. Frontiers in plant science, 6, 401.
- Turvey, N. D., & Smethurst, P. J. (1983). Nitrogen fixing plants in forest plantation management. In Biological nitrogen fixation in forest ecosystems: foundations and applications (pp. 233-259). Springer, Dordrecht.
- Ultra Jr, V. U., Mendoza, D. M., & Briones, A. M. (2005). Chemical changes under aerobic composting and nutrient supplying potential of banana residue compost. Renewable Agriculture and Food Systems, 113-125.
- Valadares, R. V., Ávila-Silva, L. D., Teixeira, R. D. S., Sousa, R. D., & Vergütz, L. (2016). Green manures and crop residues as source of nutrients in tropical environment. Organic fertilizers-from basic concepts to applied outcomes 1ed. InTech. pp, 51-84.
- van Eekeren, N. J. M., Bokhorst, J. G., & Brussaard, L. (2010). Roots and earthworms under grass, clover and a grass-clover mixture. In 19th World Congress of Soil Science, Soil Solutions for a Changing World, 1–6 August 2010, Brisbane, Australia (pp. 27-30).
- Van Sambeek, J. W., Navarrete-Tindall, N. E., & Hunt, K. L. (2008). Growth and foliar nitrogen concentrations of interplanted native woody legumes and pecan. In In: Jacobs, Douglass F.; Michler, Charles H., eds. 2008. Proceedings, 16th Central Hardwood Forest Conference; 2008 April 8-9; West Lafayette, IN. Gen. Tech. Rep. NRS-P-24. Newtown Square, PA: US Department of Agriculture, Forest Service, Northern Research Station: 580-588. (Vol. 24).
- Verma, S. (2016). A review study on Leucaena leucocephala: a multipurpose tree. Int J Sci Res Sci Eng Technol, 2(2), 103-105.
- Villar, R., Robleto, J. R., De Jong, Y., & Poorter, H. (2006). Differences in construction costs and chemical composition between deciduous and evergreen woody species are small as compared to differences among families. Plant, Cell & Environment, 29(8), 1629-1643.
- Vogel, C. S., & Curtis, P. S. (1995). Leaf gas exchange and nitrogen dynamics of N2‐fixing, field‐grown Alnus glutinosa under elevated atmospheric CO2. Global Change Biology, 1(1), 55-61.
- Walpola, B. C., & Arunakumara, K. K. I. U. (2010). Effect of particle size of Gliricidia leaves and soil texture on N mineralization. Journal of Agricultural Sciences–Sri Lanka, 4(3).
- Wang, Z., Lu, J., Yang, M., Yang, H., & Zhang, Q. (2015). Stoichiometric characteristics of carbon, nitrogen, and phosphorus in leaves of differently aged lucerne (Medicago sativa) stands. Frontiers in plant science, 6, 1062.
- Warrier, Kannan. (2010). Albizia lebbeck.
- West, S. A., Kiers, E. T., Simms, E. L., & Denison, R. F. (2002). Sanctions and mutualism stability: why do rhizobia fix nitrogen?. Proceedings of the Royal Society of London. Series B: Biological Sciences, 269(1492), 685-694.
- Whistler, W. A., & Elevitch, C. R. (2006). Erythrina variegata (coral tree). ELEVITCH, CR Traditional trees of pacific islands: their culture, environment, and use. Holualoa: Permanent Agriculture Resources, 329-344.
- Whitesell, C. D., & Parrotta, J. A. (2008). Leucaena leucocephala (Lam.) de Wit. Woody Plant Seed Manual.
- Wilson, R., Culp, D., Peterson, S., Nicholson, K., & Geisseler, D. (2019). Cover crops prove effective at increasing soil nitrogen for organic potato production. California Agriculture, 73(2), 79-89.
- Wivstad, M. (1999). Nitrogen mineralization and crop uptake of N from decomposing 15N labelled red clover and yellow sweetclover plant fractions of different age. Plant and Soil, 208(1), 21-31.
- Woods, M., & Leverett, L. (2010). The genus Indigofera (Fabaceae) in Alabama. Journal of Alabama Academy of Science Vol, 81(1).
- Woźniak, M., Gałązka, A., Grządziel, J., & Frąc, M. (2018). Microbial diversity of Paulownia spp. leaves–A new source of green manure. BioResources, 13(3), 4807-4819.
- Xiang, W., & Bauhus, J. (2007). Does the addition of litter from N-fixing Acacia mearnsii accelerate leaf decomposition of Eucalyptus globulus?. Australian Journal of Botany, 55(5), 576-583.
- Xu, B., Xu, W., Wang, Z., Chen, Z., Palta, J. A., & Chen, Y. (2018). Accumulation of N and P in the legume Lespedeza davurica in controlled mixtures with the grass Bothriochloa ischaemum under varying water and fertilization conditions. Frontiers in plant science, 9, 165.
- Yahaya, D., Denwar, N., Mohammed, M., & Blair, M. W. (2019). Screening Cowpea (Vigna unguiculata (L.) Walp.) Genotypes for Enhanced N2 Fixation and Water Use Efficiency under Field Conditions in Ghana. American Journal of Plant Sciences, 10(4), 640-658.
- Yamawaki, K., Matsumura, A., Hattori, R., Tarui, A., Hossain, M. A., Ohashi, Y., & Daimon, H. (2014). Possibility of introducing winter legumes, hairy vetch and faba bean, as green manures to turmeric cropping in temperate region. Plant Production Science, 17(2), 173-184.
- Yu, M., Xie, W., Zhang, X., Zhang, S., Wang, Y., Hao, Z., & Chen, B. (2020). Arbuscular Mycorrhizal Fungi Can Compensate for the Loss of Indigenous Microbial Communities to Support the Growth of Liquorice (Glycyrrhiza uralensis Fisch.). Plants, 9(1), 7.
- Zaccheo, P. V. C., Neves, C. S. V. J., de Cinque Mariano, D., Zorzenoni, T. O., Higashibara, L. R., Piccinin, G. G., & Okumura, R. S. (2016). Green manure in fruticulture: Aspects on soil quality and use in agriculture. African Journal of Agricultural Research, 11(17), 1469-1474.
- Zavala-Sierra, D., Rodríguez-Ortiz, J. C., Alcalá-Jáuregui, J. A., Ruiz-Espinoza, F. H., Mancillas, R. G., Rodríguez-Fuentes, H., & Sánchez, P. D. Potential of five legume species as green manure in the highland area of San Luis Potosí, Mexico.
- Zeng, Q., Lal, R., Chen, Y., & An, S. (2017). Soil, leaf and root ecological stoichiometry of Caragana korshinskii on the Loess Plateau of China in relation to plantation age. PloS one, 12(1), e0168890.
- Zhou, Z. C., & Shangguan, Z. P. (2009). Effects of elevated CO2 concentration on the biomasses and nitrogen concentrations in the organs of sainfoin (Onobrychis viciaefolia Scop.). Agricultural Sciences in China, 8(4), 424-430.